目录:
第一部分 仿制药一致性评价概述
第二部分仿制药一致性评价标准化研究流程
第三部分仿制药一致性评价药学研究策略
第一部分 仿制药一致性评价概述
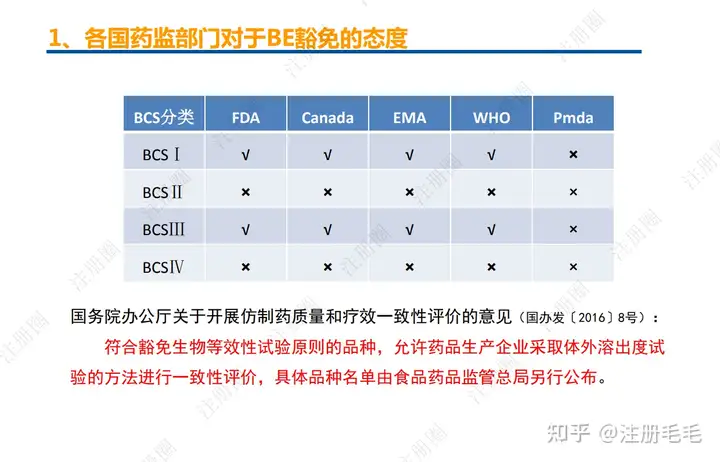
一致性评价是一个综合性、系统性的评价体系
体系一致性:1. 生产体系2. 质量保证体系 3. 环保体系4. 药物评价体系5. 培训体系6. 召回体系
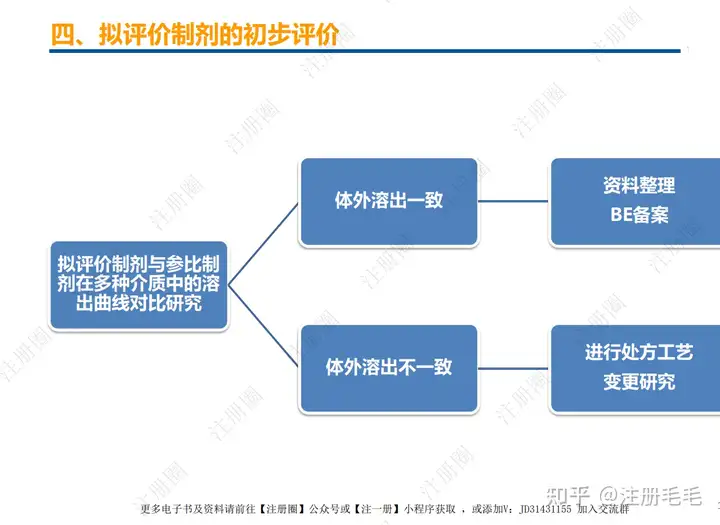
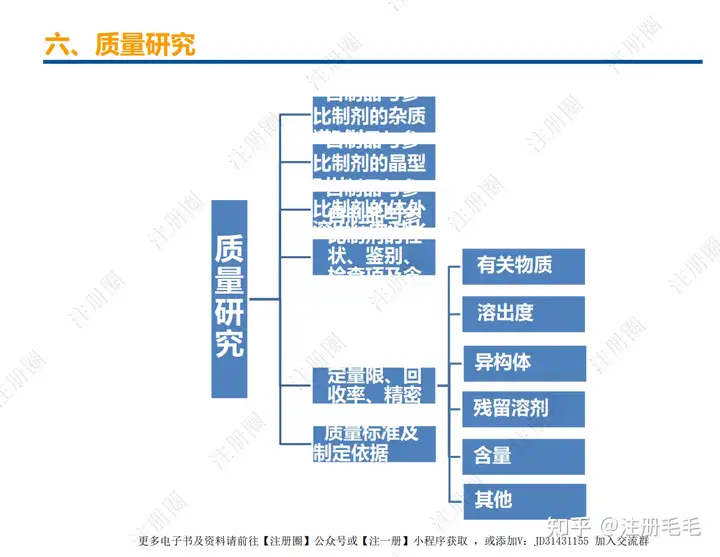
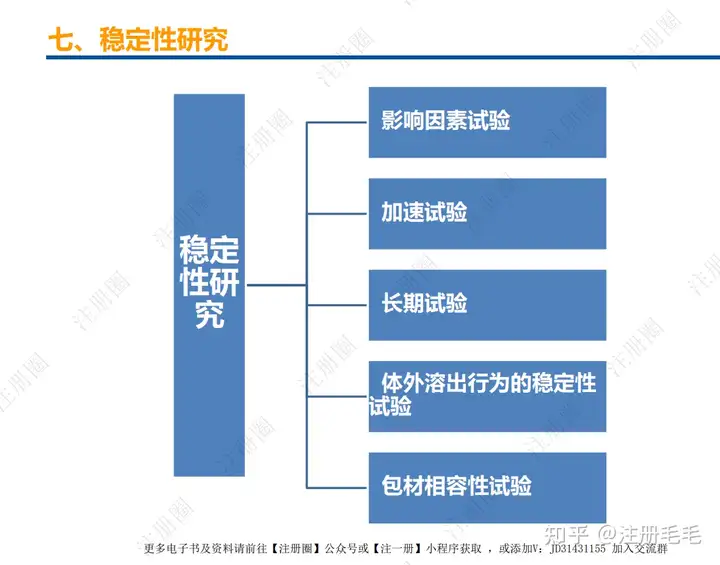
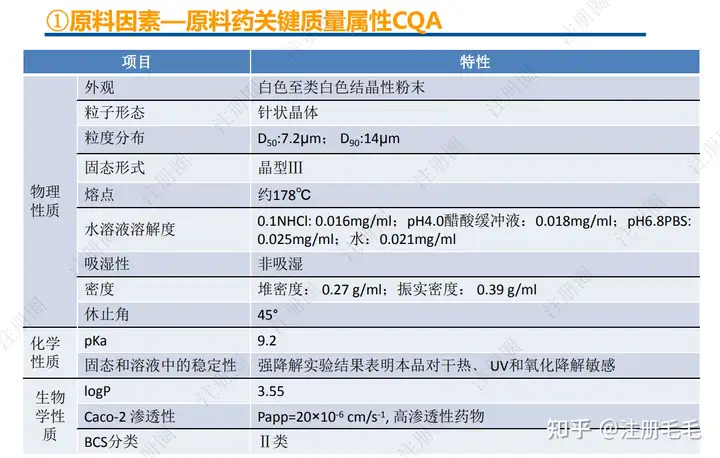
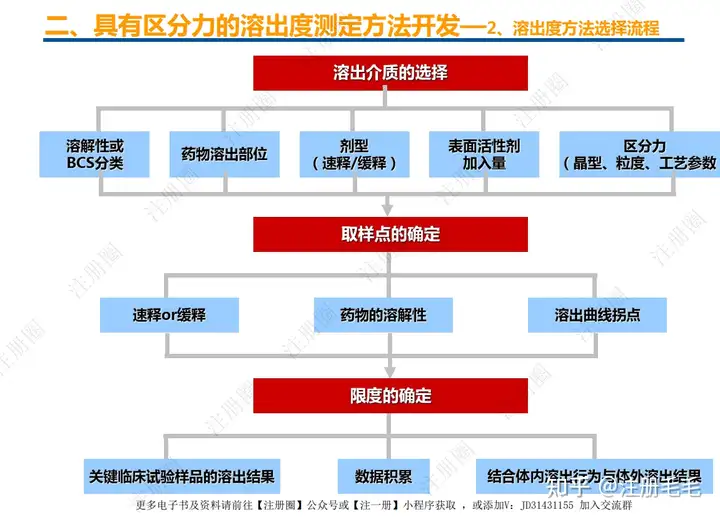
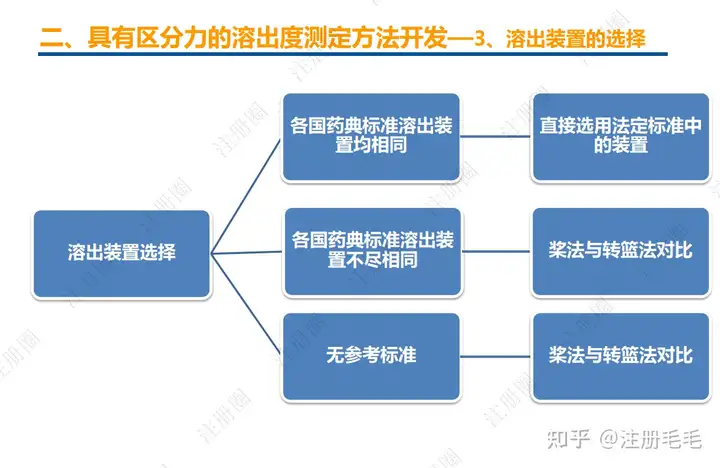
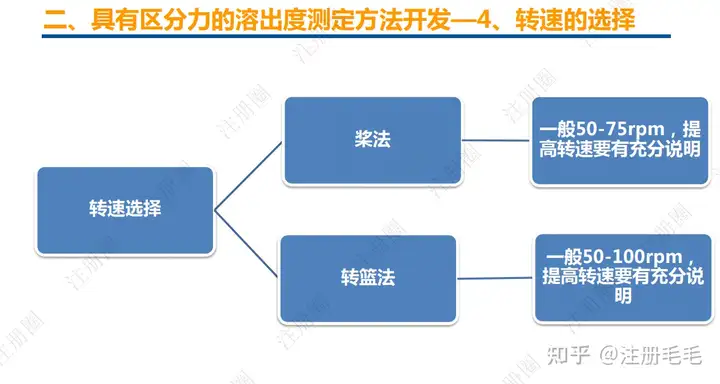
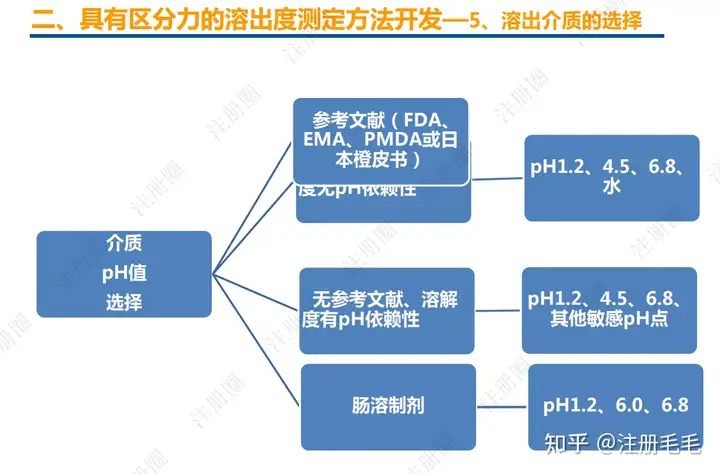
药学一致性:1. 制剂2. 原辅料 3. 包材4. 杂质5. 货架期6. 批间重现性7. 批生产规模8. 晶型9. 工艺10.体外溶出度
临床一致性:1.生物等效性2.临床等效性3.说明书一致4.药物警戒与风险管理5.上市后的疗效和安全性临床研究。
药学一致”是一致性评价的基石
体系一致---药学一致---生物等效---治疗等效
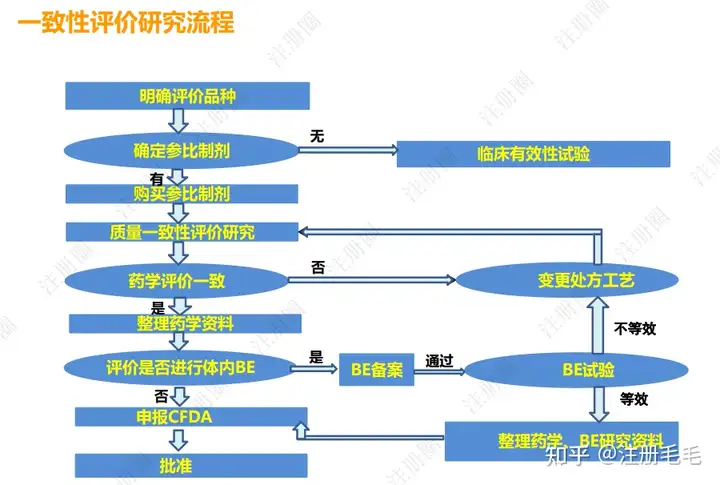
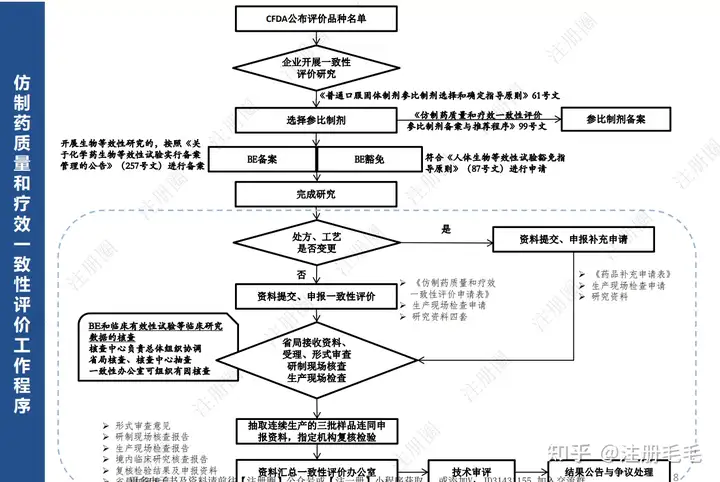
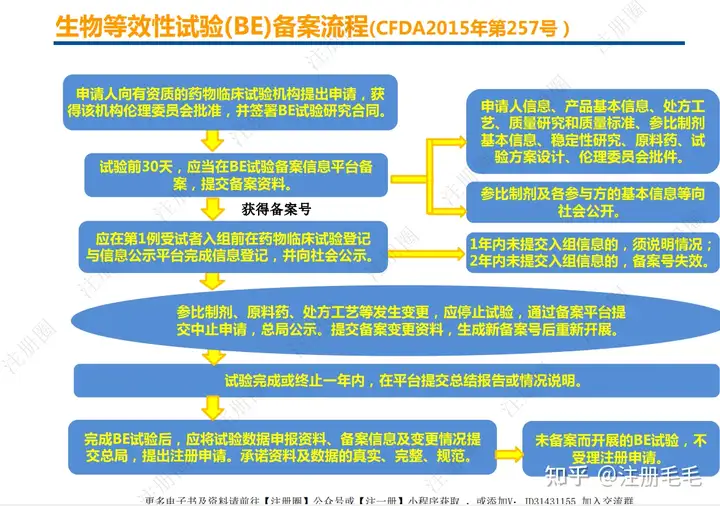
一致性评价研究流程
第二部分
仿制药一致性评价标准化研究流程
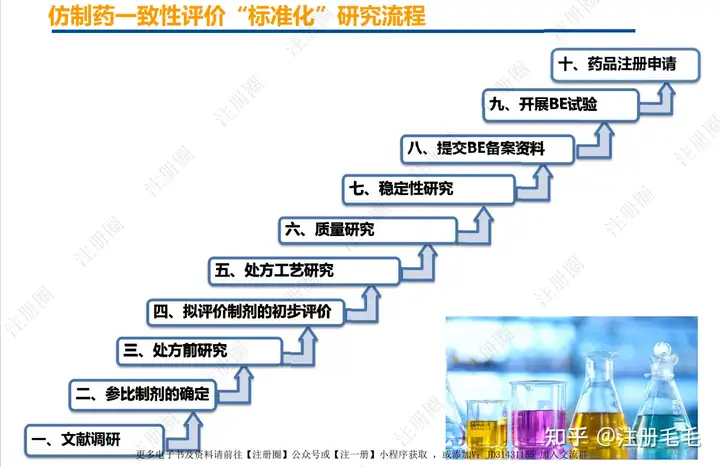

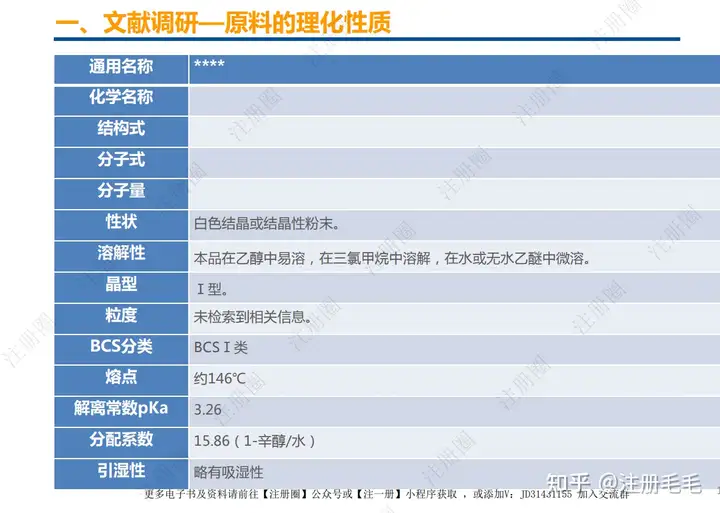
二、参比制剂的确定
1.参比制剂首选国内上市的原研药品,作为参比制剂的进口原研药品应与其原产国上市药品一致。若原研企业证明其地产化药品与原研药品一致,也可用。
2.若原研药品未在国内上市或有证据证明原研药品不符合参比制剂的条件,也可以选用在国内上市国际公认的同种药物作为参比制剂,其产品应与被列为参比制剂国家的上市药品一致。
3.若原研药品和国际公认的同种药物均未在国内上市,可选择在欧盟、美国、日本上市并被列为参比制剂的药品。
4.药品生产企业提出
5.行业协会推荐u原研药、国际公认生产企业可主动申报u一致性评价办公室 60个工作日内未提出异议的,企业即可开展相关研究工作。
6.企业购买,应有合法证明文件;境外购买,应提供办理一次性进口所需的《进口药品批件》,批次和数量应满足研究及复核检验的需要。
7.主动申报作为参比制剂的药品生产企业,应保障参比制剂的质量与可及性
8.一致性评价办公室把企业备案的、行业协会推荐、企业主动申报的参比制剂信息向社会公开,以供企业参考
9.CFDA及时公布确定的参比制剂信息,药品生产企业原则上应选择公布的参比制剂开展一致性评价
第三部分 仿制药一致性评价药学研究策略


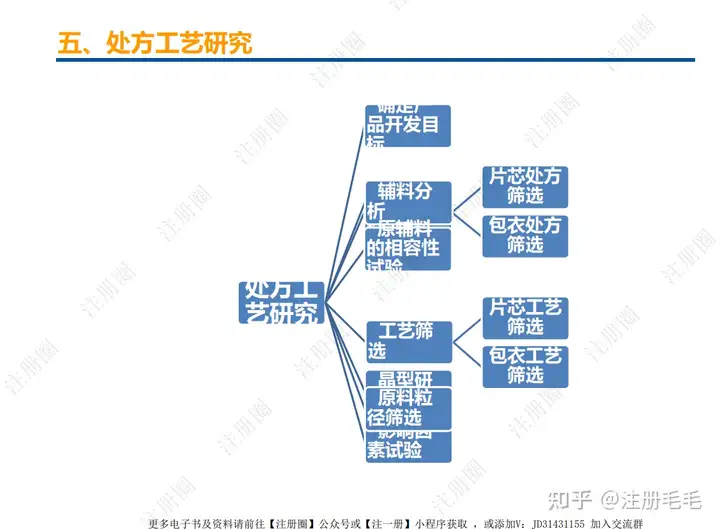
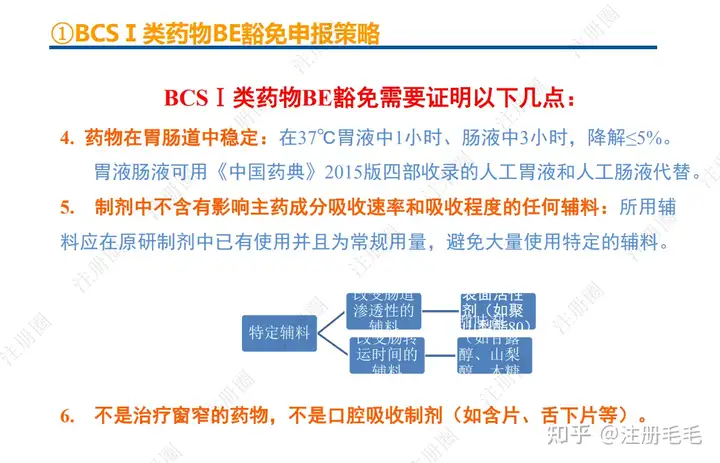
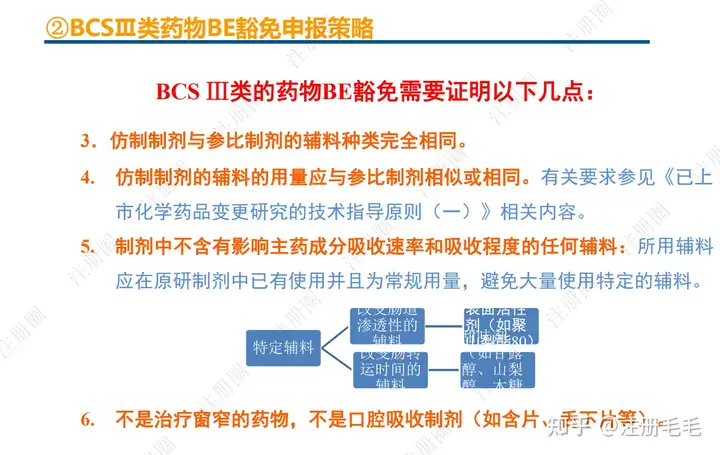
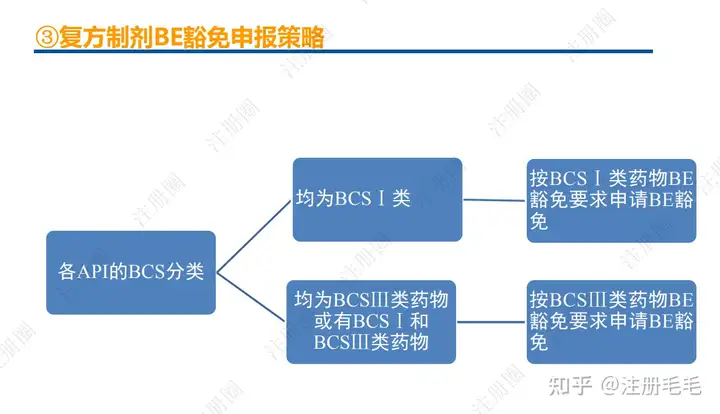
一、口服固体制剂的处方工艺开发—相关定义
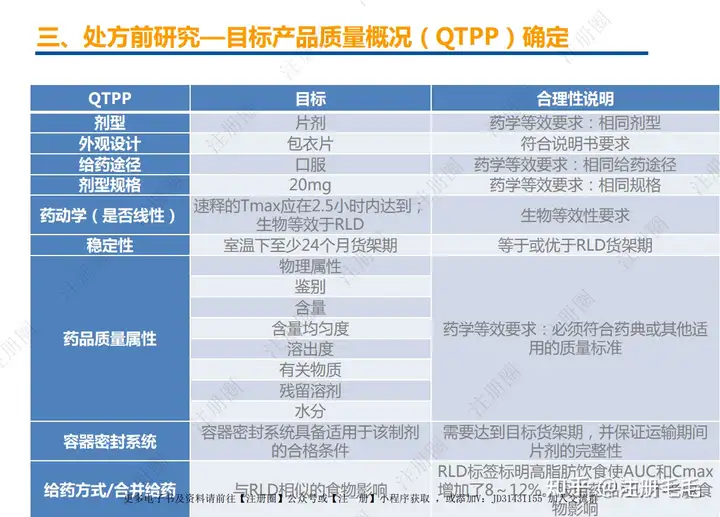
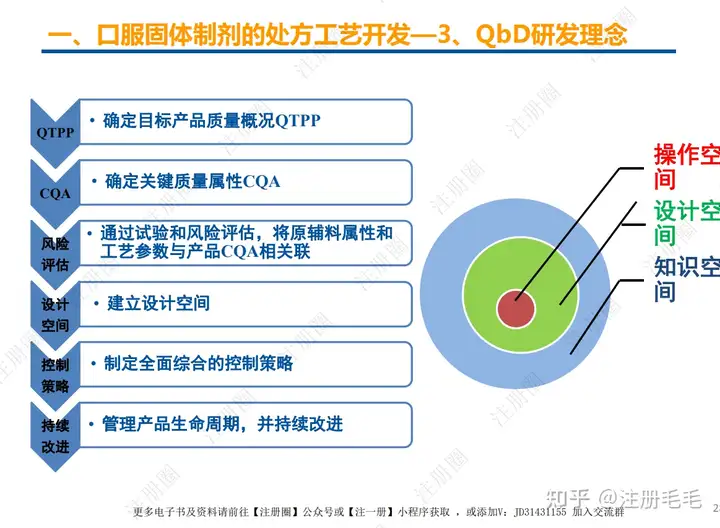
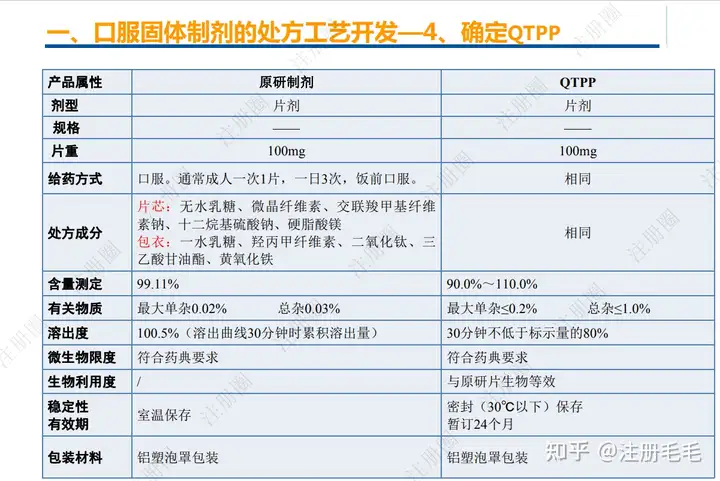
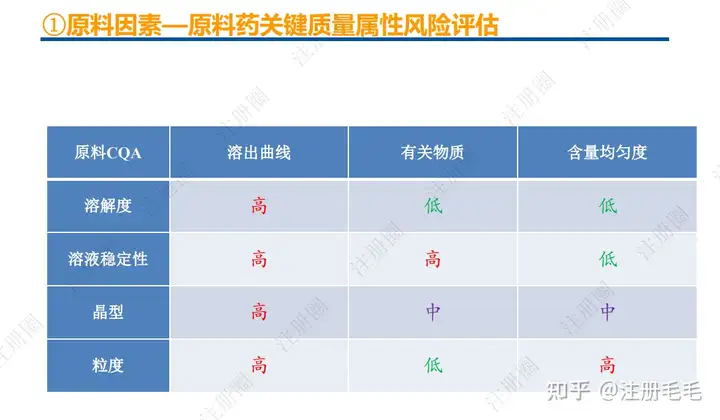
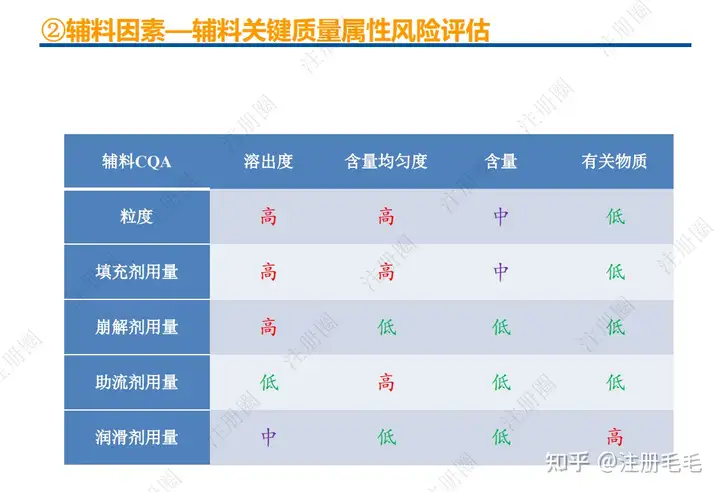
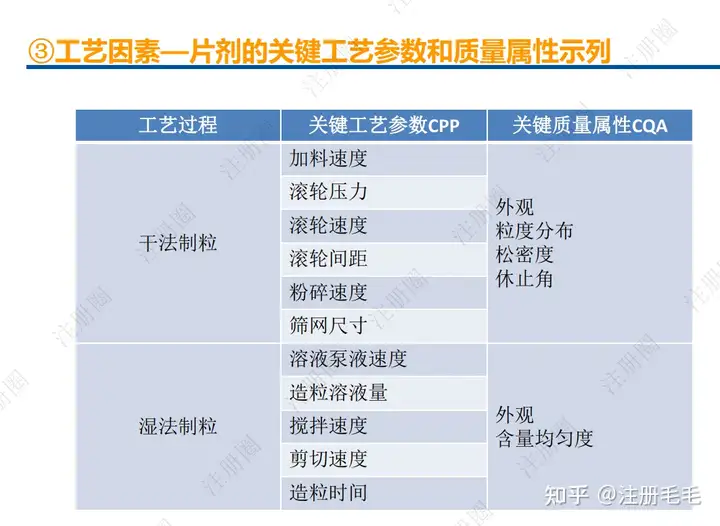
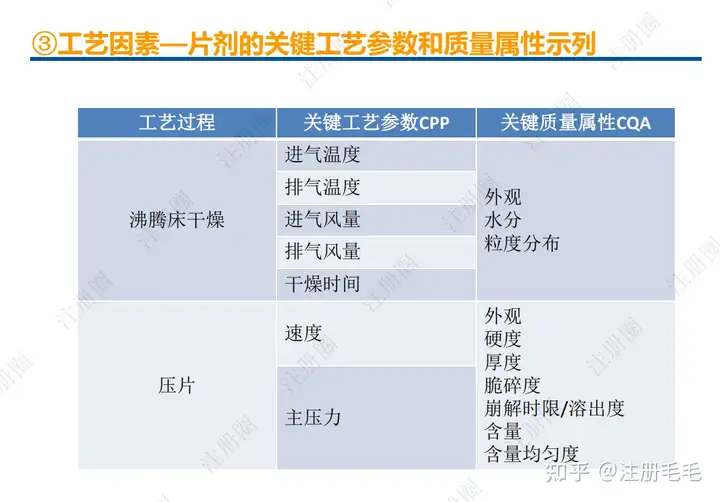
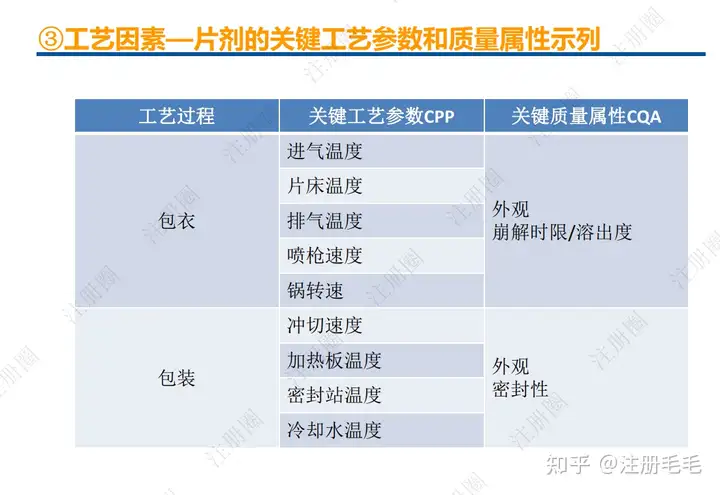
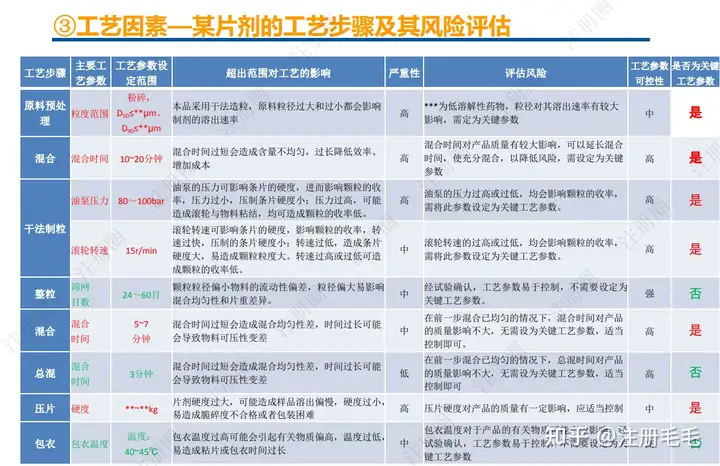
1、相关定义135设计空间(Design Space) 是指已确定的输入变量和工艺参数范围,已论证在该范围内可以保证质量。在设计空间内运行通常不被认为是变更。超出了设计空间就会被看作是变更,通常会启动监管批准后的变更程序。设计空间由申请人提出,提交给监管部门评价和批准。目标产品质量概况(Quality Target Product Profile,QTPP): 是(基于对原研产品的分析认识)关于药品质量特性的预先设定的一系列目标,确保药品质量,并考虑其安全性和有效性。关键质量属性(Critical quality attribute,CQA): 指物质的物理、化学、生物学或微生物学性质或特征,其应当被限制在适当的限度、范围或分布内,以保证预期的产品质量。关键工艺参数(Critical process parameter,CPP): 为过程参数,其变动会影响到产品的关键质量属性,因此需要被监测和控制,以确保过程能生产出预期质量的产品。
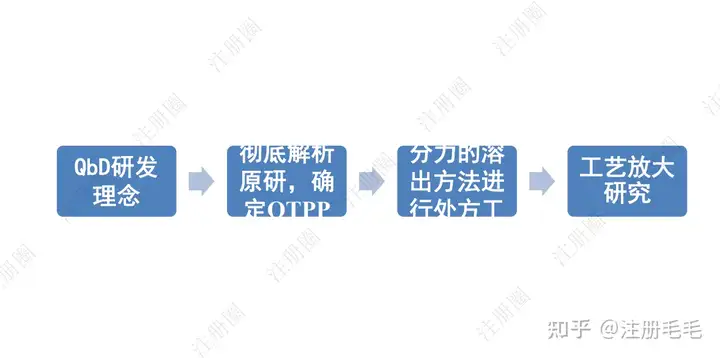
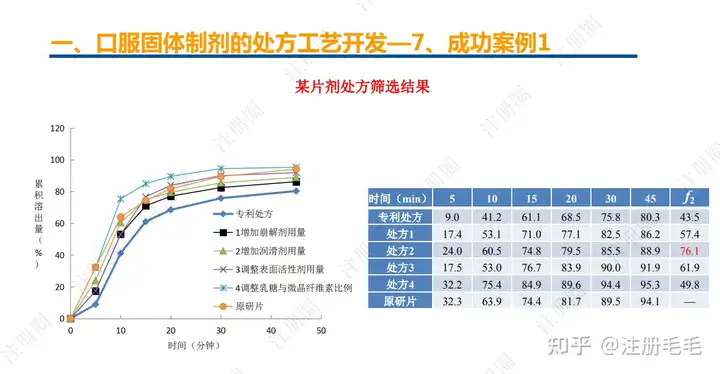
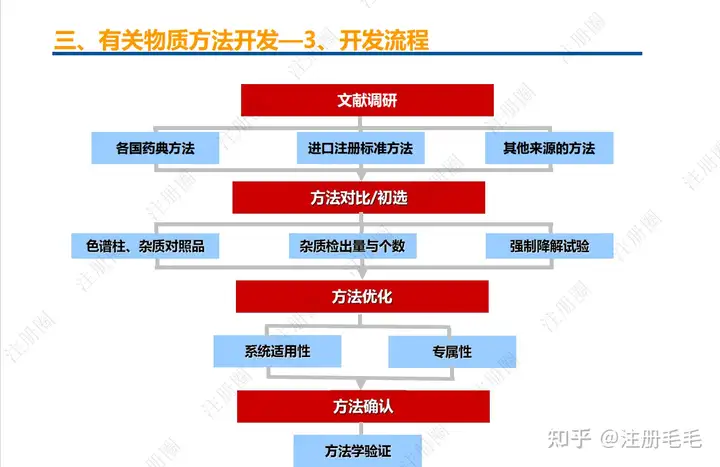
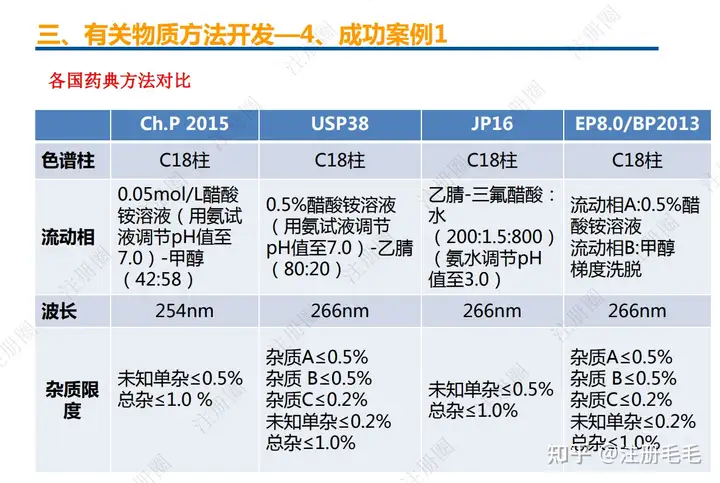
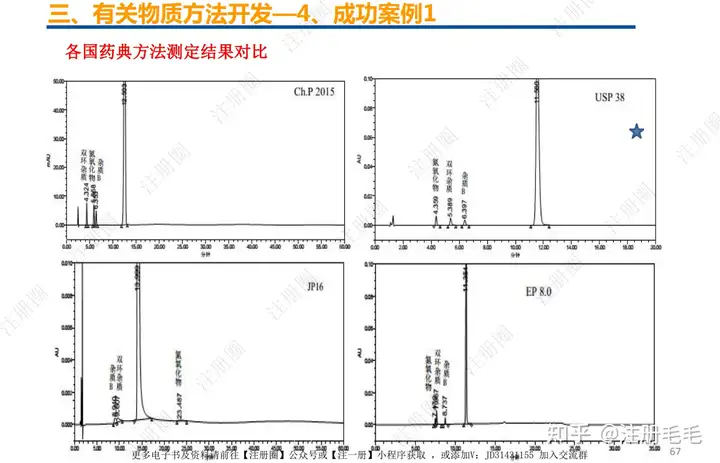
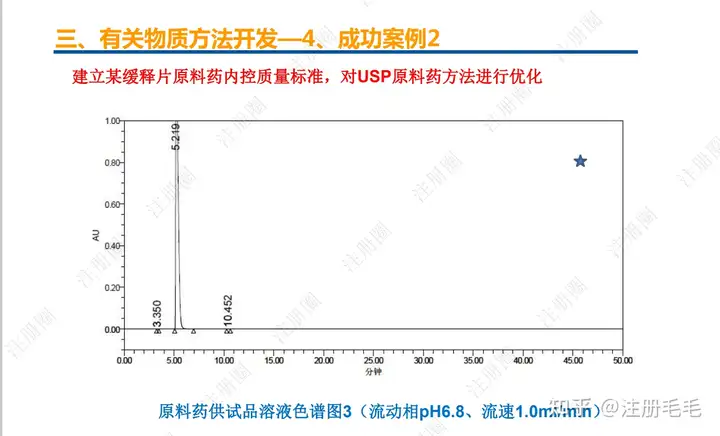
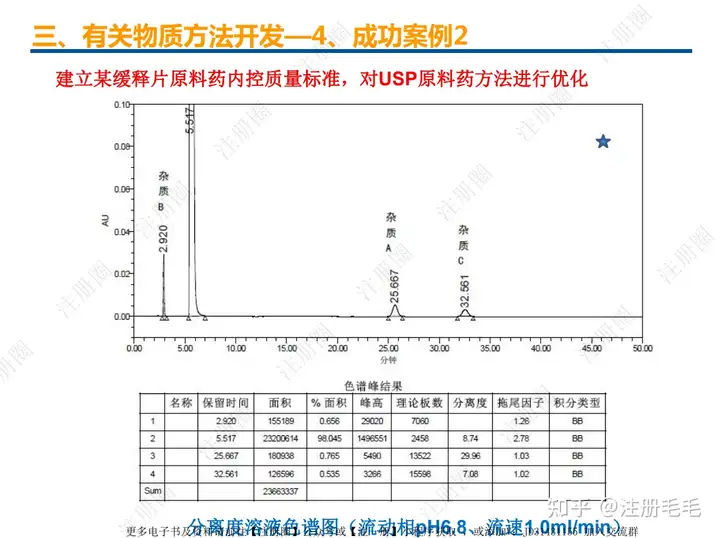
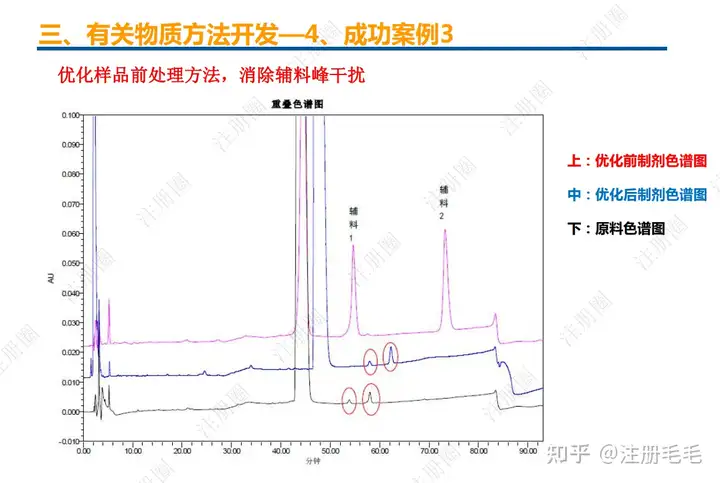
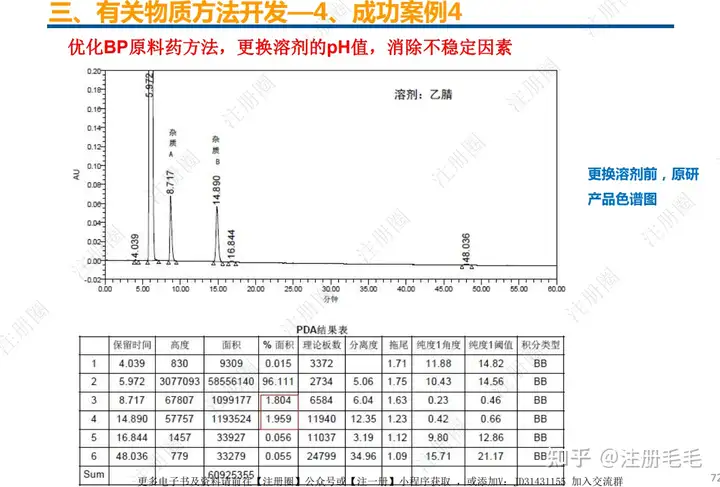
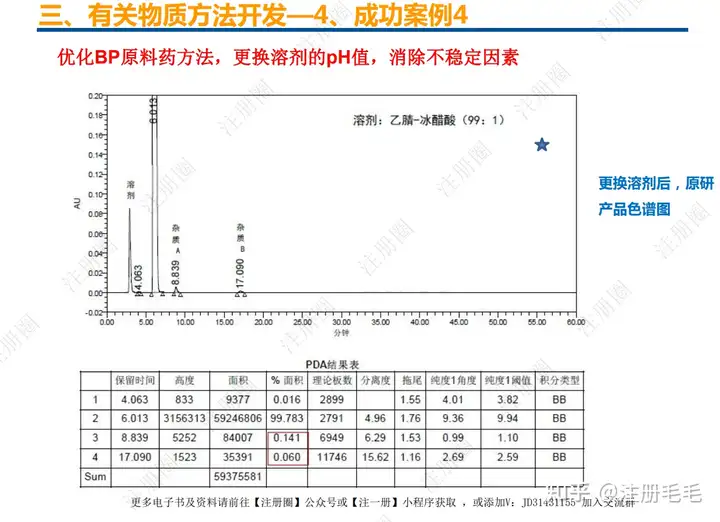
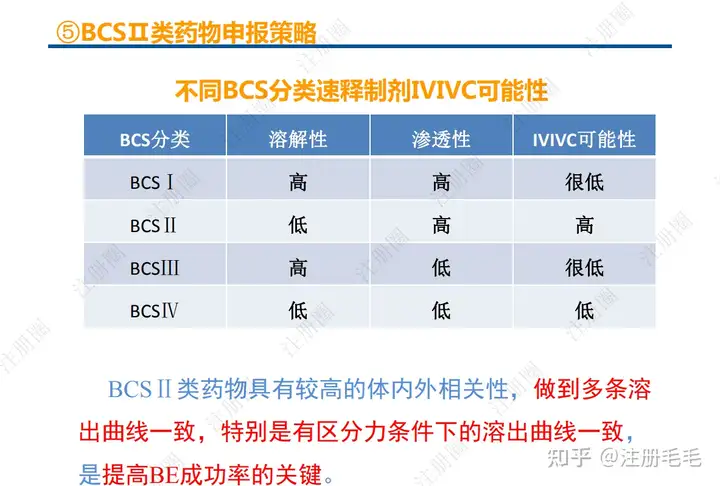
二、口服固体制剂的处方工艺开发—2、成功基石




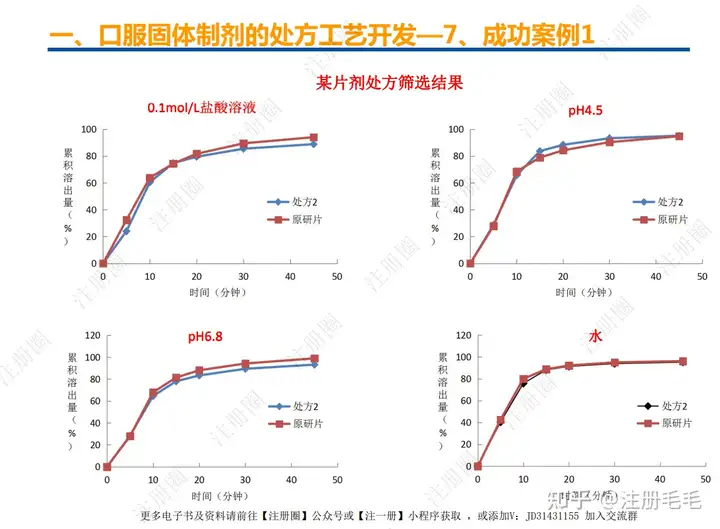
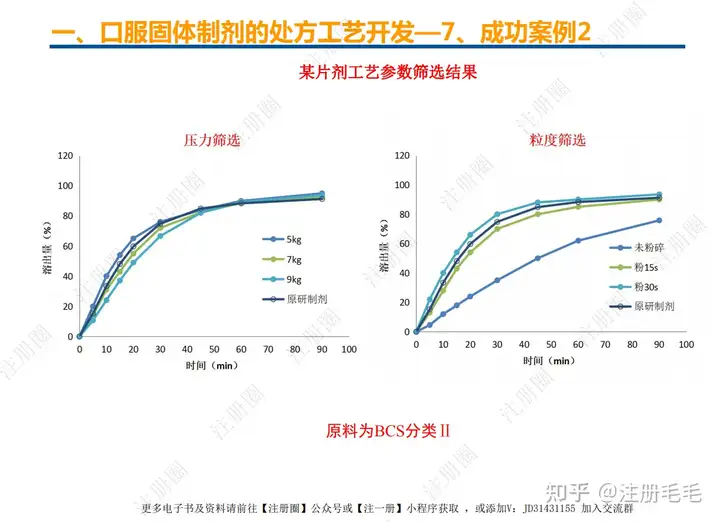
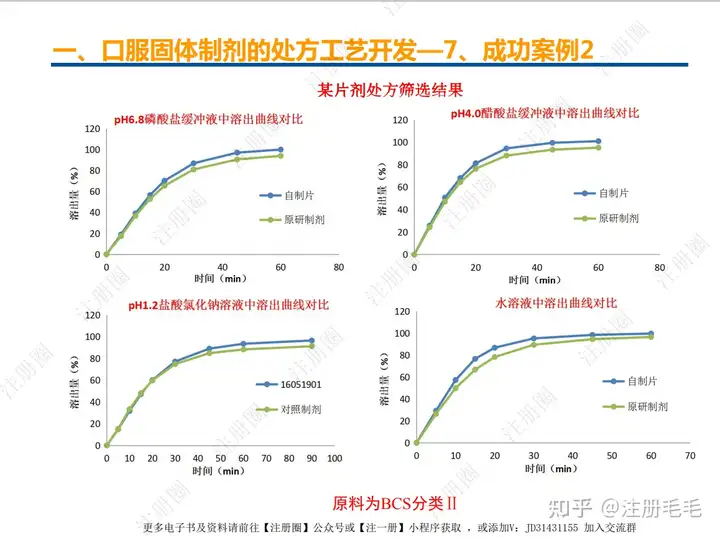




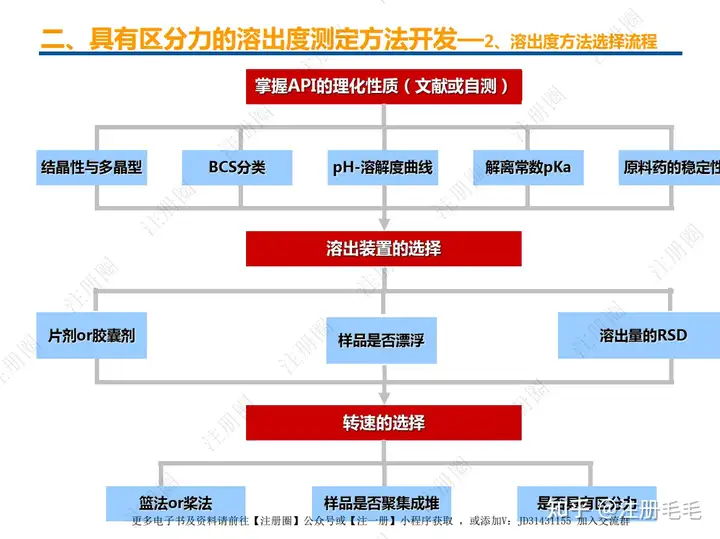
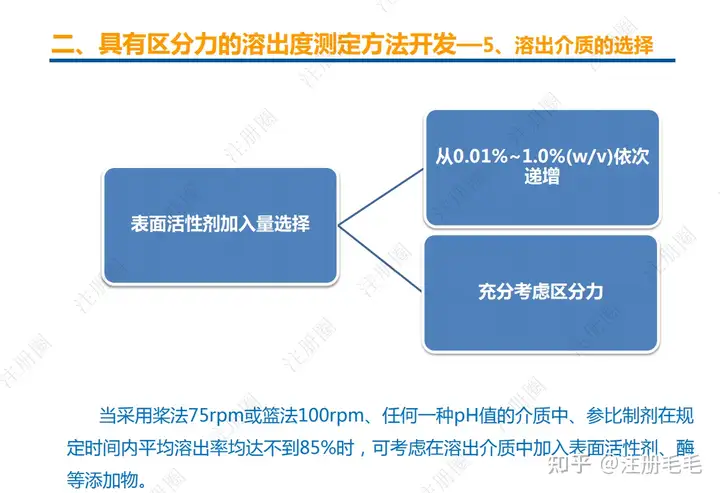
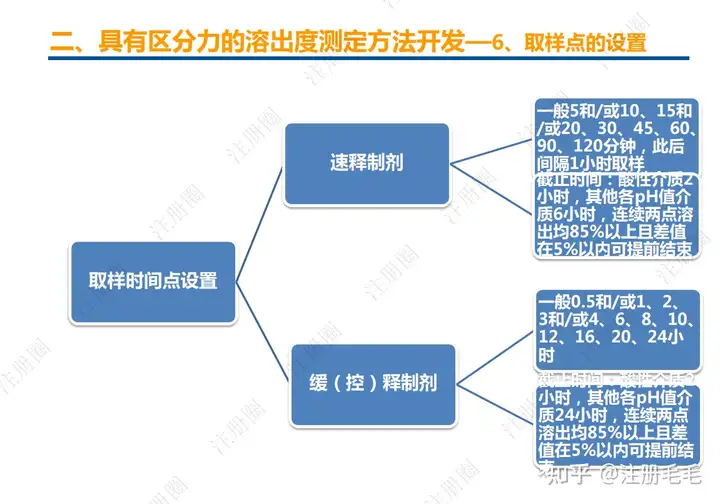
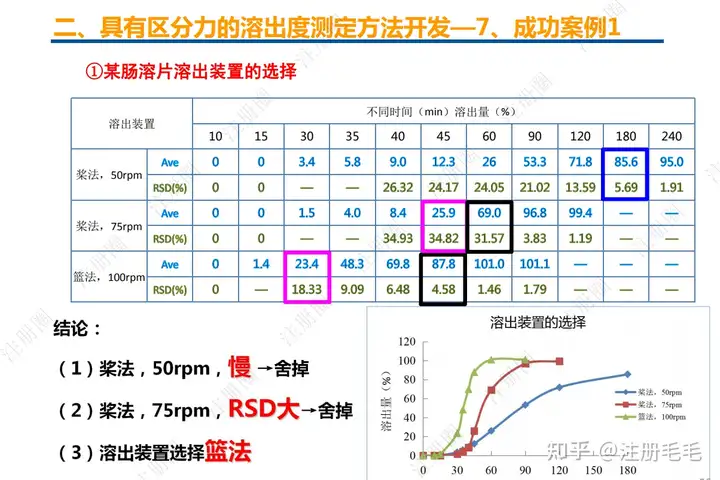
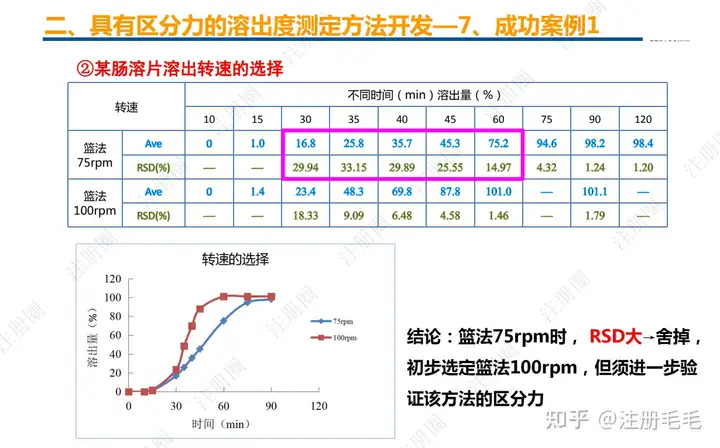
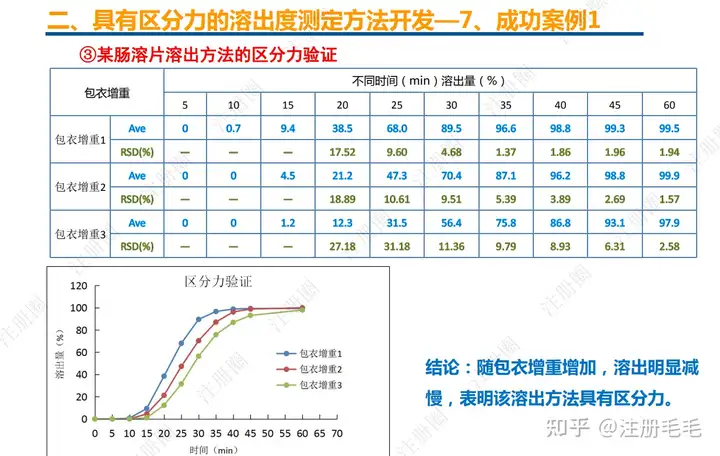
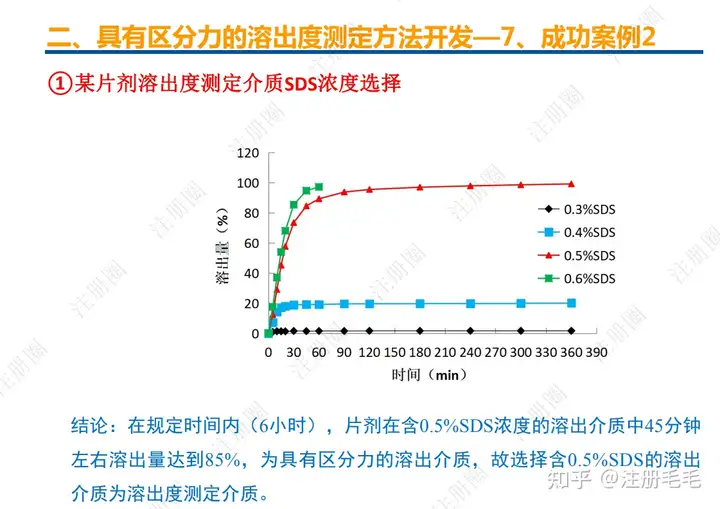
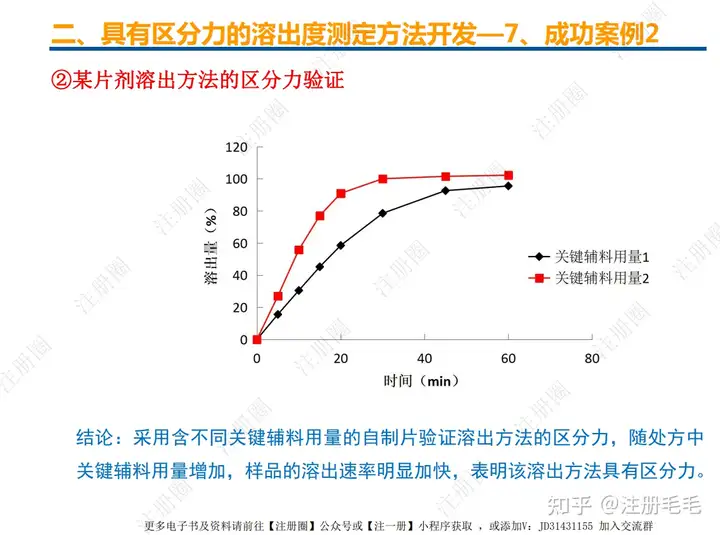


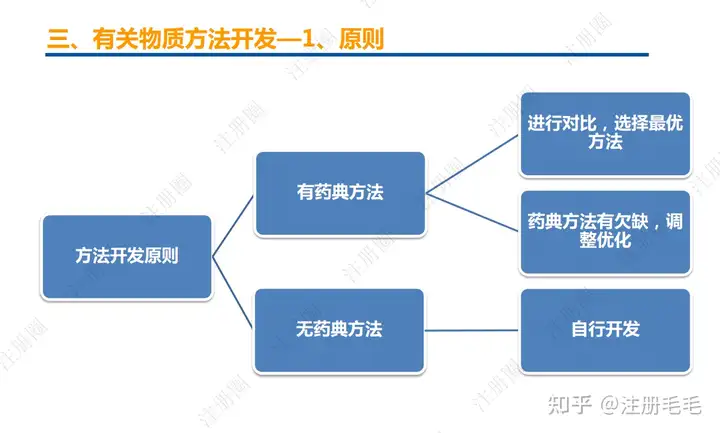










文章来自 注册圈 ,注册圈是由注册人自发兴起的社群,是目前医药注册高度活跃的社群平台。以专业的群友和丰富的资源为基础,为注册人、研发人、合规人、医药人提供法规学习、药品研发、立项、注册申报、信息检索等资源共享互助平台。同时为企业提供相关人才招聘、项目发布和对接新渠道。
作为一个从事药物注册行业的工作者而言,我个人在这个平台获益蛮多的 平台有不少关于药物注册的资源 皆是免费提供给想要学习新的注册知识的同行,比网络上一些收费的平台要好很多。有需要的可以了解下~